新澳门今晚开奖直播现场分子影像与核医学研究中心李桢教授团队通过抑制免疫代谢检查点CD73,增强T细胞浸润量及功能活性,联合放化疗提高脑胶质瘤的免疫疗效。相关成果以“Boost Infiltration and Activity of T Cells via Inhibiting Ecto-5′-nucleotidase(CD73) Immune Checkpoint to Enhance Glioblastoma Immunotherapy”为题发表在ACS NANO杂志上。论文链接:https://pubs.acs.org/doi/epdf/10.1021/acsnano.4c04553。
目前免疫检查点疗法对脑胶质瘤的疗效欠佳,因此探索更好的免疫检查点及其靶向策略至关重要。免疫代谢检查点CD73在恶性脑胶质瘤中过表达,会造成细胞外腺苷(ADO)的失调,显著抑制抗肿瘤T细胞的功能并增加免疫抑制细胞的活性,进而导致肿瘤细胞的免疫逃避。因此,抑制免疫代谢检查点CD73具有增强肿瘤免疫治疗疗效的潜力。目前通过抑制CD73,增强脑胶质瘤免疫治疗存在以下不足:(1)抗体或小分子抑制剂无法高效穿越血脑屏障富集于脑胶质瘤部位;(2)脑胶质瘤放化疗耐受性强,免疫响应性差。因此,针对上述不足,发展靶向抑制CD73和提高脑胶质瘤免疫响应性的新策略具有重要意义。
在前期研究中,研究团队构建了“富含空位”的多模态诊疗一体化超小Cu2-xSe纳米颗粒(Adv. Mater. 2016, 28, 8927; ACS Nano, 2017, 11, 5633-5645; ACS Nano, 2019, 13, 1342;Adv. Funct. Mater. 2020, 30, 1906128;Nano Today. 2022, 46, 101601)。这些纳米颗粒不仅可以诱导肿瘤细胞发生免疫原性死亡、改变肿瘤免疫抑制微环境(Bioact. Mater. 2022, 16, 418;Adv. Funct. Mater. 2022, 32, 2108971;ACS Nano. 2024, 18, 6333-6347),还可以缓解T细胞功能障碍、增强T细胞活性(Adv. Sci. 2023, 2204961)。因此它们是开展肿瘤免疫治疗、提高抗肿瘤疗效的理想纳米颗粒。
基于上述研究基础,研究人员合理设计了核壳结构Au@Cu2-xSe纳米颗粒(ACS NPs)。该纳米颗粒不仅可以抑制放疗引发的肿瘤细胞保护性自噬及DNA损伤修复(Biomaterials 2022, 280, 121287),而且可以抑制脑胶质瘤CD73的表达,缓解ADO引起的免疫抑制性,提高抗肿瘤T细胞浸润量和功能活性。此外,ACS NPs释放的铜离子(Cu2+)可以与双硫仑螯合,在肿瘤原位形成化疗药物(CuET),联合放疗可以释放更多的肿瘤相关抗原,招募更多的T细胞浸润至肿瘤部位。基于CD73的抑制作用,提高抗肿瘤T细胞的浸润量和功能活性,有效增强了脑胶质瘤的免疫治疗效果。肿瘤内CD8+ T和CD4+ T细胞以及脾脏中的记忆T细胞显著增加,原位脑胶质瘤抑制率达到92%。该工作表明,调节CD73介导的肿瘤免疫抑制可以有效提高脑胶质瘤免疫治疗疗效。
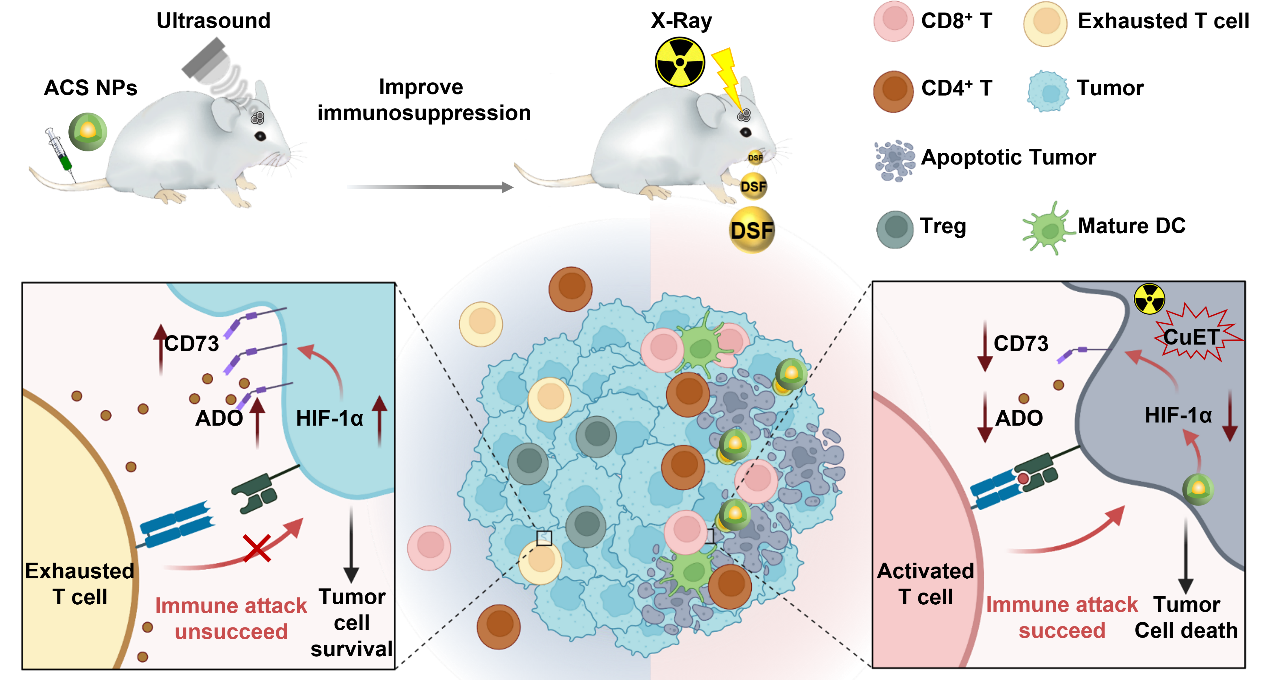
图1联合治疗策略及其治疗机制示意图。
本论文第一作者张浩为苏州大学医学部放射医学与防护学院博士后,放射医学与辐射防护国家重点实验室王婷婷副教授和李桢教授为本文的共同通讯作者,苏州大学为该论文第一单位。该工作得到国家自然科学基金(82101927,32101110、92374113)、苏州医学院基础前沿交叉创新项目(YXY2303025)、江苏省卓越博士后计划等项目资助。